La DBP es un heterodímero formado por las cadenad A y B. Aunque las secuencias son muy parecidas, se observan diferencias en la orientación de sus dominios (Verboven et al. 2002).
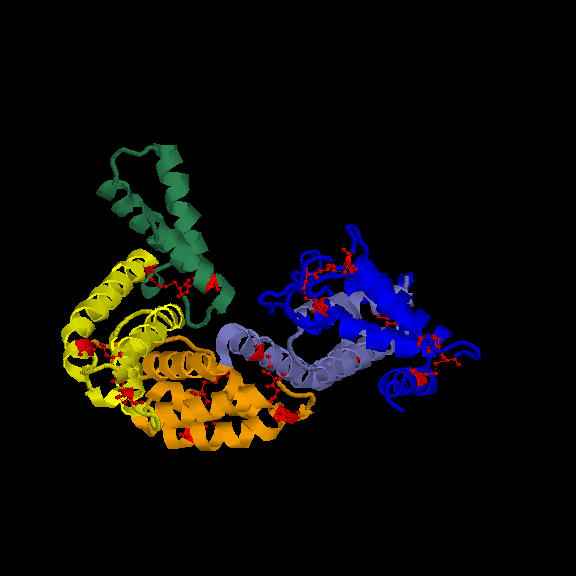
Por su estructura, pertenece a la clase de familias todo a y tiene un plegamiento del tipo serum-albumin like (Scop). Se distinguen claramente 3 dominios estructurales similares, lo que indican que proceden de la triplicación de un precursor común. A su vez, cada dominio está dividido en dos subdominios relacionados estructuralmente, lo que indica que el precursor ancestral sufrió una duplicación previa a la triplicación. El dominio III está truncado en la región C-terminal con respecto al resto de los miembros de la familia, por lo que presenta sólo un subdominio. Hay 28 cisteínas, formando 14 puentes disulfuro, 6 en el primer dominio, 6 en el segundo y 2 en el último. Son estos puentes disulfuro los que mantienen la estructura en dominios de la proteína (Fig 1).
Fig 1. Estructura DBP. Señaladas en rojo las Cisteínas formando puentes disulfuro.
Dominio IEl dominio I presenta una estructura general de 10 hélices a y está dividido a su vez en dos subdominio similares. El subdominio a está formado por las primeras 6 hélices: las primeras 4 forman un cluster que está flanqueado por 2 hélices cortas, la 5 y la 6; el segundo subdominio (subdominio b) forma otro cluster de 4 hélices. Un largo y extendido loop une los dos subdominios.
La unión de los dominios I y II se realiza a través de la Glicina 209. Esta glicina provoca una torsión de las hélices adyacentes, articulándose un movimiento de bending.
Dominio II
El dominio II también presenta la misma estructura que el I, excepto que la hélice 6 se ha convertido en un largo loop, que une los dos subdominios, por lo que queda el subdominio IIa formado por 5 hélices y el IIb por 4.
Dominio III
El dominio III, al estar truncado en la región C–terminal sólo presenta el subdominio a, formado también por 4 hélices.

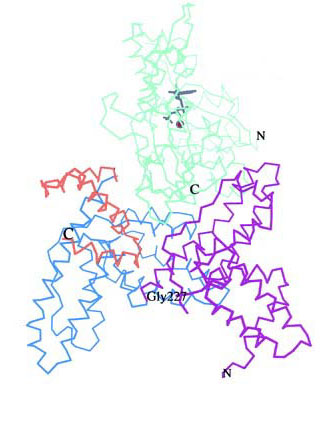 Esta
unión involucra los tres dominios que forman una cavidad donde
se asientan los polímeros de actina. Los contactos entre la actina
y DBP son una combinación de interacciones hidrofóbicas y
electrostáticas incluyendo puentes de hidrógeno, y un gran
número de contactos mediados por moléculas del solvente.
Los residuos Thr196 y Arg 218 son los más importantes en estas
interacciones.Tras la unión a la actina, la parte C-terminal del
dominio I y el loop de conexión de los dominios II y III se mueven
ligeramente para contactar directamente con la actina, pero en general,
no se observa un cambio sustancial de conformación.
Esta
unión involucra los tres dominios que forman una cavidad donde
se asientan los polímeros de actina. Los contactos entre la actina
y DBP son una combinación de interacciones hidrofóbicas y
electrostáticas incluyendo puentes de hidrógeno, y un gran
número de contactos mediados por moléculas del solvente.
Los residuos Thr196 y Arg 218 son los más importantes en estas
interacciones.Tras la unión a la actina, la parte C-terminal del
dominio I y el loop de conexión de los dominios II y III se mueven
ligeramente para contactar directamente con la actina, pero en general,
no se observa un cambio sustancial de conformación.